据国外媒体报道,所谓的“设计婴儿”(designer baby)可能不再是一件非常遥远的事。2017年,我们见证了许多基因工程领域的新闻,其中大部分都涉及对基因片段进行剪切和粘贴(即基因编辑)的CRISPR技术。
最引人关注的一个新闻是,CRISPR可以修改人类胚胎,纠正一种相对常见且往往致命的突变。
从事这一前沿研究的是颇具争议的美国细胞生物学家舒哈拉特·米塔利波夫(Shoukhrat Mitalipov)。他表示,他的团队不仅使用CRISPR来修改新受精胚胎中的突变,而且所采用的机制如果不算新颖,至少也是非同寻常。科学界很快对此做出了直接且负面的反应。他们并不认同这一实验。近日,在米塔利波夫曾发表最初成果的《自然》(Nature)杂志上,有两组研究人员发表了对其2017年论文的尖锐批评——文中充满了首字母缩写词和各种示意图。米塔利波夫试图做出回应,因为如果科学性不能保证的话,伦理问题就不那么重要了。
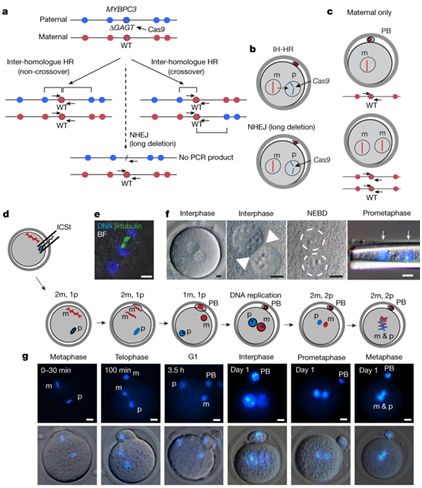
我们都知道婴儿是怎么产生的,对吧?米塔利波夫的团队并没有以常规方法来获得胚胎。在美国,利用已有的人类胚胎进行科学研究在绝大多数情况下是禁忌,因此科学家采用含有突变型MYBPC3基因的精子使正常人类卵子受精。这种突变基因会引发名为肥厚性心肌症的疾病,而该疾病是导致年轻运动员猝死的最常见原因。具有两份突变型MYBPC3基因拷贝——分别来自母亲和父亲,或者用遗传学术语说,是同源的等位基因——的人很少能在儿童时期存活下来。只具有一份拷贝(杂合子)的人往往会随年龄增长而出现心脏问题。
为了修正这一变异,米塔利波夫的团队利用CRISPR技术将变异基因从父系染色体中剪切出来,然后插入一个合成的修改版本。不过,基因编辑的第二步并没有发生。相反,根据米塔利波夫的分析,细胞复制了来自母体染色体的野生型基因,并将其插入到剪切位置。结果就是,胚胎具有两个野生型等位基因。这一过程被称为“同源依赖性修复”或“同源(基因)间修复”。
“一些作者一直在研究DNA修复,不知为何他们忽视了这头房间里的大象(比喻问题因太过庞大或麻烦而没有人愿意去碰),”在俄勒冈州卫生科学大学担任胚胎细胞与基因治疗中心主任的米塔利波夫说,“我们指的是基因修复领域中有一道巨大的知识鸿沟。我们不确定它是否发生在体细胞谱系中,但是在胚胎谱系中,我们现在已经证明了这一点。”
胚胎学家和细胞生物学家并不认为他们忽视了“大象”。他们认为所谓的“大象”并不存在。一篇批评文章的第一作者、南澳大利亚健康与医学研究所SA基因组编辑主管保罗·托马斯(Paul Thomas)说:“我们认为有另一种解释。”托马斯的工作显示,在小鼠身上,CRISPR往往会从基因组中剪切出大块的DNA,即所谓的“大段删除”(large deletion)。他猜测米塔利波夫研究组的胚胎中也发生了同样的过程,而他们忽视了大段删除造成实验失败的可能。“如果染色体上发生了大段删除,你就需要具体地分析这一事件,”托马斯说,“如果你是用他们所用的检测方法,一种非常标准的检测方法,那就无法检测出来。”
换句话说,这就像在一天结束之后,通过计算货架上的东西来弄清楚面包店制作了多少种百吉饼。统计数据会告诉你,这家面包店主要制作蓝莓口味,但这是因为像蒜香、加盐和原味等口味在你统计之前就已经卖完了。你的统计会高估蓝莓口味占所有百吉饼的比例。
这是否可能是小鼠和男性的问题?当然有可能。“很显然,有越来越多的研究发现了小鼠胚胎中的大段删除。尚不清楚的是,人类胚胎中是否也发生了大段删除,目前我们只有屈指可数的一些研究结果,”托马斯说道。
于是,米塔利波夫的团队又回到了实验室。他们将原先的样品拿出来,重新进行了检测。他们采用的是聚合酶链式反应(PCR)技术,可以对足够大量的DNA进行测序和分析。这一次,他们分析了染色体中较长的一段。“我们的检测使用了大规模PCR,检测了超过10000个碱基对,但我们还是没看到任何删除,”米塔利波夫说道。他原本就不期待有什么发现。他的小组在第一篇论文中报告了修复基因突变的成功率大约为70%。米塔利波夫表示,很难相信他的研究中有70%的胚胎具有CRISPR引起的大段删除;如果真的这样,那这种技术就无法适用了。
事情并没有就这么结束。“我们非常惊讶他们没有在回应文章中提及的任何样品中发现任何删除的证据,”托马斯说,“我们认为他们并没有完全排除这种可能性。”托马斯的论文合著者之一法特瓦·阿迪库苏马(Fatwa Adikusuma)提出,更加精准的检测方法——比如qPCR(能定量分析DNA的量)——或许可行。米塔利波夫还没有尝试过这种方法。
其他团队也有各自的问题。例如,由哥伦比亚大学的迪亚特·艾格利(Dieter Egli)和纪念斯隆-凯特琳癌症中心的玛利亚·贾辛(Maria Jasin)所领导的研究小组(包括直言不讳的哈佛大学生物技术专家乔治·丘奇)关注了CRISPR复合体如何能获得母体野生型基因的问题,因为早期的细胞分裂中,母体和父体的贡献是分开的。米塔利波夫称,原核中的亲本DNA有足够的接触时间,使修复过程起作用。“如果这种说法是对的,那么这些胚胎中没有出现更多的镶嵌现象就很令人费解,”加州大学戴维斯分校的细胞生物学家保罗·诺福勒(Paul Knoepfler)说道。“镶嵌”现象是指单个生物的不同细胞中具有不同的基因组。“CRISPR的介入时间太晚,比如在双细胞胚胎阶段,这很可能会导致不同的基因结果,”诺福勒说道。这些可能会在之后产生不太健康的胚胎。
所以,有没有可能米塔利波夫是对的?玛利亚·贾辛说:“正如论文中所说,新的数据与基因修复结果是一致的。”不过她也表示,米塔利波夫的回应表明了这类研究有多么困难。在他的研究中,有一个胚胎显示出“等位基因脱扣”(allele dropout)的现象,即研究团队无法在双亲中同时检测到等位基因。玛利亚·贾辛补充道:“我们不确定同源基因间重组引起的基因修复是否发生在所有胚胎中,或者部分胚胎中,或者在最极端情况下,没有一个胚胎发生这样的修复。”
包括米塔利波夫在内,所有人都表示,这一切还需要更多研究才能有确定答案。对他来说这没有什么关系;他明白人们对他所说的话和所做的事都有很多担忧。如果他的方法确实有效,那也只能适用于具有单个野生型基因拷贝的胚胎。一方面,细胞必须具有一个野生型基因版本才能复制。但更重要的是,新的想法需要更多时间和工作才能渗透到一个领域中。“现在有很多教条,特别是在生物学领域,”米塔利波夫说,“而我们带着实验结果闯入了这个领域,说这是人类胚胎中一种未知但十分强大的修复途径。”
想让“教条”为这种方法让路显然需要时间。“在某种程度上,米塔利波夫的团队加强了他们的实例,”诺福勒说,“也许这指明了我们从根本上理解早期人类胚胎中新机制的方向,但也有可能在一年之后,我们将以完全不同的角度看待这一问题。”当然,无论哪种结果,对于最终的临床实践,都要求超过70%的成功率。这也意味着,科学家还需要在实验室中进行更多的工作,努力使原本非常遥远的事情变得更有现实可行性。(任天)